中国科学技术大学教授朱书团队在肠道免疫研究中取得新进展,并对GSDMD在食物耐受中的功能进行了新解读。6月15日,相关研究成果以 Gasdermin D licenses MHCII induction to maintain food tolerance in the small intestine 为题,发表在《细胞》( Cell )上。
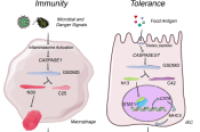
GSDMD蛋白作为介导细胞焦亡(pyroptosis)的关键执行蛋白,近些年来备受领域内学者的关注。当细胞受到病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)的刺激时,细胞内的信号感受器会以炎症小体(inflammasome)依赖或非依赖的方式激活caspase-1/4/5/8/11对GSDMD的N端切割产生p30片段进而上细胞膜成孔引发细胞焦亡和炎性因子释放。这些功能主要是在髓系细胞中进行探索时被发现,而在生理状态下,GSDMD在多种组织器官中均有广泛表达,并作为gasdermin家族的成员,GSDMD在肠道尤其小肠也有着极高的表达量,GSDMD的非焦亡功能以及在肠道发挥什么具体的生理作用也因此成为亟待探索的科学问题。
科研人员针对生理状态下各个组织细胞的GSDMD进行蛋白印迹检测,发现了检测的各组织样品中只有在小肠的上皮细胞(IEC)中能检测到一条约13kD大小的剪切带,进一步发现这一条剪切带来自GSDMD的N端且由食物抗原激活十二指肠IECs中的CASPASE-3/7切割GSDMD的88位天冬氨酸(人源GSDMD是87位)产生。研究通过免疫荧光染色以及RNA-seq等实验手段发现, N 13 片段会入核诱导前端小肠IEC的二类分子表达水平。研究运用单细胞RNA测序等手段发现, N 13 片段缺失造成IEC二类分子下降会进一步导致Tr1细胞减少。由于Tr1细胞被认为是诱导食物耐受的关键细胞之一,研究猜测 N 13 片段最终会参与诱导食物耐受。为此,研究针对多种基因表达背景小鼠构建了两组食物耐受模型——花生提取物诱导的花生过敏模型以及OVA诱导的迟发型超敏反应模型,最终证实GSDMD在肠道的生理功能之一是参与构建宿主食物耐受。
该研究阐述了GSDMD在前端小肠中会在食物诱导下形成一个 N 13 片段。该片段在核孔复合物帮助下入核并辅助增强了STAT1对Ciita的转录调节,使IEC的二类分子表达增加,从而诱导Tr1的上调,最终促进食物耐受形成,为食物过敏的治疗手段提供新思路。
研究工作得到科学技术部、国家自然科学基金委员会和中国科学院的支持。
GSDMD分子在不同细胞中应对病原以及食物抗原,通过产生不同的剪切形式,上膜打孔或入核参与转录分别诱导免疫激活或免疫耐受,体现了同一个免疫分子的功能两面性。
来源:中国科学技术大学
本账号稿件默认开启 微信 “快捷转载”
转载请注明出处
其他渠道转载请联系 weibo@cashq.ac.cn




