基因药物优势显著,可以克服传统药物调控蛋白质水平的局限,已成为破解疑难疾病的重要手段,在遗传、非遗传疾病领域的应用价值日益凸显,2023年截至12月8日已有6款基因治疗产品获批上市。随着CRISPR、单碱基编辑(BE)、先导编辑(PE)等基因编辑技术,以及AAV载体、脂质纳米颗粒(LNP)、病毒样颗粒(VLP)等递送技术快速发展,基因药物研发加速,并受到资本市场的持续关注。国内多家基因治疗公司加码基因药物赛道,在研管线覆盖罕见病、眼科、中枢神经系统等疾病领域,基因疗法迎来快速发展阶段。
12月18日,弗若斯特沙利文(Frost & Sullivan,以下简称“沙利文”)正式发布《基因药物行业现状与发展趋势蓝皮书》(以下简称《蓝皮书》),报告剖析基因药物行业现状,追踪行业和技术发展脉络,挖掘行业发展巨大潜力,分析市场发展背后的驱动因素,以期为基因药物赛道参与者和关注者提供参考。
1
基因药物行业概览
基因药物是指利用介导载体将正常或具有治疗性的外源基因转导至靶细胞中,置换或校正致病基因的一种方法。目的基因或与靶细胞染色体整合,或不整合位于染色体外,但均能在细胞中转录和翻译,改变细胞原有基因表达情况,起到治疗疾病的目的。
自首款基因药物问世至今的近20年里,全世界范围内获批上市的基因药物已有12款。基因工程和药物递送技术的快速发展加速基因药物研发,应用领域除遗传病外还覆盖到了恶性肿瘤、慢性病和传染病等领域。
《蓝皮书》梳理了基因治疗的定义及分类、基因药物治疗机制及优势、基因药物发展历程、基因药物应用领域等内容。更多详细内容可参见完整版报告。
2
基因药物制备的相关技术
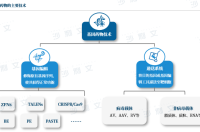
基因药物运用病毒或非病毒载体将目的基因递送入患者体内,达到治疗疾病的目的。基因药物相关技术主要包括基因编辑技术(如CRISPR/Cas9)和递送系统技术(病毒载体、非病毒载体),基因编辑技术可编辑基因序列,起到替换、沉默或增补基因的作用;递送系统可携带治疗性基因或基因编辑工具并将其导入靶细胞。
来源:沙利文研究
CRISPR/Cas技术
CRISPR/Cas技术基于原核生物抵御外来病毒及质粒DNA的一种适应性免疫系统开发的第三代基因编辑技术。通过人工设计的sgRNA(guide RNA)识别目的基因组序列,引导Cas蛋白酶有效切割DNA双链,最终达到对基因组DNA进行修饰的目的。其中Cas9蛋白和Cpf1蛋白是最常用的蛋白酶。作为当今最广泛使用的基因编辑技术,CRISPR/Cas平台较ZFNs和TALENs具有低价格、高灵活性、多靶向等优势,促使从科研到临床的快速转化。目前,CRISPR/Cas技术广泛应用于体外分子诊断、基因标记、单碱基编辑等领域。2023年11月,全球首款CRISPR基因编辑造血干细胞药物Casgevy在英国获批有条件上市许可,适应症为镰刀型细胞贫血病伴复发性血管闭塞危象、输血依赖型β地中海贫血。
来源:沙利文研究
病毒递送系统
病毒在感染宿主细胞后会将自身的遗传物质导入宿主细胞中,这些基因序列会在宿主细胞中进行蛋白质表达。基于该原理,通过改造天然病毒将目标基因置入病毒基因序列中,便可利用病毒向靶细胞传递目标基因。常见的病毒载体包括逆转录病毒(Retrovirus)、慢病毒(Lentivirus)、腺病毒(Adenovirus)、腺相关病毒(Adeno-associated virus,AAVs)、单纯疱疹病毒(Herpes simplex virus,HSV)等,其中AAVs因其较低的免疫原性和成熟的生产工艺,是近年来热门的病毒载体。
《蓝皮书》介绍了基因编辑技术(ZFNs、TALENs、CRISPR、BE、PE、PASTE)、递送系统技术(病毒递送系统、LNP、VLP),以及相关技术进展;梳理了基因编辑技术在体外细胞疗法中的应用及上市产品;并总结了基因药物研发的核心要点。更多详细内容可参见完整版报告。
3
基因药物领域监管机制
美国基因药物监管现状
美国卫生与公共服务部(United States Department of Health and Human Services,HHS)下属食品药品监督管理局(FDA)、美国人类研究保护办公室(Office for Human Research Protections,OHRP)、美国国立卫生研究院(National Institutes of Health,NIH)共同负责美国基因药物监管工作。其中,FDA下设生物制品评价与研究中心(Center for Biologics Evaluation and Research,CBER)及其子部门组织与先进疗法办公室(Office of Tissues and Advanced Therapies,OTAT)负责对基因药物产品的IND、NDA、BLA审查。
欧盟基因药物监管现状
欧洲药品管理局(EMA)的先进疗法委员会(CAT)负责基因药物品临床试验审批、上市申请、产品分类和认证等,其主要的法律法规依据为医药产品法(Medicinal products 2001/83/EC)及ATMP医疗产品法规(Regulation(EC) No 1394/2007),按集中审评程序审批。通过审评的产品由人用药品委员会做出最后建议,最终推荐EMA批准后授予认证证书并由EMA继续检测药品的安全性和有效性。
日本基因药物监管现状
日本将基因治疗、细胞治疗、组织工程产品从药品、医疗器械的再生医学产品中独立出来单独监管,重新修订了《药事法》,并于2013-2014年连续出台了《再生医学促进法》和《再生医学安全法》,作为基因药物产品发展的法律依据。日本再生医疗领域的主要国家监管部委包括厚生劳动省、经济产业省、文部科学省、医药品医疗器械综合机构。四个机关单位在研究推动、设计开发、许可认定、品质评价、程序审查等具体事务上各有侧重和分工协作,另外日本标准协会(Japanese Standards Association,JSA)负责安全性评价等行业标准制定。
中国基因药物监管现状
中国在基因药物领域的基础研究和临床试验开展较早,首个临床试验可追溯到1991年(B型血友病患者展开的基因药物治疗临床试验),但当时对基因药物的监管政策法规相对滞后,对于研究开发的多个环节设计的具体内容没有详细要求与规定,约束性不强。2003年,国家药监局发布“人类基因治疗研究和剂型质量控制技术指导原则”,逐步开始加强基因药物的监管。2018年,中国开始加强对基因药物及生物安全等领域的技术指导和法律法规制定。近年来相继发布《基因治疗产品长期随访临床研究技术指导原则(试行》《基因治疗产品非临床研究与评价技术指导原则(试行)》《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》《体内基因治疗产品药学研究与评价技术指导原则(试行)》等文件,持续优化我国基因药物监管体系。
《蓝皮书》详细梳理了美国、欧盟、日本和中国对于基因药物的监管情况和主要政策。更多详细内容可参见完整版报告。
4
基因药物领域研发现状与市场潜力
截至2023年11月,全球有12款基因药物获批上市。治疗领域覆盖肿瘤、血液系统疾病、神经系统疾病、眼科、骨骼肌肉系统等。
来源:沙利文研究
《蓝皮书》剖析了上市基因药物及基因药物在研管线情况,对先天性黑蒙、脊髓性肌肉萎缩、膀胱癌、血友病B、结晶样视网膜色素变性、亨廷顿舞蹈症、艾滋病等适应症的基因药物上市产品情况或在研管线进展进行梳理,分析基因药物市场驱动及未来发展趋势。更多详细内容可参见完整版报告。
5
基因药物领域公司资本市场表现
《蓝皮书》梳理了基因药物赛道近年来国内外公司融资情况、行业合作开发与收购并购事件。更多详细内容可参见完整版报告。
6
基因药物领域部分公司介绍
本导基因
本导基因成立于2018年,公司专注于开发基因创新药物,以“研发更好的基因治疗递送技术,治疗更多无药可治的重大疾病”为使命,建立国际领先的创新递送技术平台BD-VLP和BDlenti,致力于“成为国内领先、国际一流的高新生物制药企业,打造全球多领域药物研发平台”。公司已在抗病毒、亨廷顿舞蹈症、青光眼、地贫/镰贫、体内DC疫苗等领域布局了核心基因治疗研发管线。
康霖生物
康霖生物是一家由海归精英团队创办,以做首创药物(First-in-Class)和同类最优(Best-in-Class)创新基因药物为目标的国家级专精特新小巨人企业。公司专注于基因治疗创新药的研发和商业化,目前已经建立了腺相关病毒(AAV)载体、慢病毒(LV)载体和造血干细胞(iHSC)三大创新技术平台,并且已在地中海贫血症、帕金森病、艾滋病和血友病等多个管线上取得了领先于国际同行的进展。凭借着独特的创新能力和专业化水平,公司先后获得了国家级高新技术企业、浙江省博士后工作站、浙江省级研发中心、杭州市准独角兽企业等多项荣誉及称号。
神曦生物
神曦生物(NeuExcell)是一家全球领先的创新型生物科技公司,致力于运用原位神经再生技术治疗神经损伤和退行性疾病。NeuExcell创始人陈功教授是国际著名的再生医学专家,管理团队来自多个国际大药企的高管,有丰富的研发和管理运营经验。NeuExcell团队以“再生神经,造福人类”为使命,开发了应用广泛的原位神经再生技术平台,可用于治疗脑中风、阿尔兹海默症、帕金森病、脑胶质瘤、视网膜疾病、渐冻症等多种疾病,为难治性神经疾病的治疗开辟了新途径。目前,公司拥有200余项国际专利申请,获批55项国际授权。
天泽云泰
天泽云泰成立于2020年,致力于将前沿的基因治疗技术,转化为临床可及的治疗方法,以造福更多患者。天泽云泰建立了一支由业内顶尖学术专家和经验丰富的研发人员组成的团队,实现药物开发从概念提出到产品上市全环节覆盖。公司建立ViVec®AAV载体筛选平台、ViLNP®脂质纳米粒技术平台、ViCas®CRISPR基因编辑技术平台和ViHiYi®AAV高产技术平台等一系列具有自主知识产权的核心技术平台,专注于开发创新性基因疗法,为中国乃至全世界遗传性疾病、神经退行性疾病患者提供解决方案。
中因科技
中因科技成立于2016年,是一家专业从事遗传眼病基因治疗药物开发和临床基因诊断的国家高新技术企业,是国内率先布局于该领域的企业之一。中因科技致力于引领基因技术创新,消除遗传眼病,为遗传性眼病患者提供精准诊断和治疗“一站式”服务。中因科技通过临床基因诊断平台建立遗传眼病数据库及专病队列,总结出中国患者中的基因突变频谱,和突变热点,为后续基因治疗药物研发提供治疗靶点;在此基础上开发具有独立自主知识产权的药物,包括基因替代治疗和基因编辑治疗,力争实现“从零到一”的突破。建立有靶标筛选、基础研究、动物实验验证、干细胞验证、AAV病毒研发和生产、临床试验运营和药物注册申报等完整的药物开发体系。中因科技诊断平台拥有当前国内唯一一家获得“CAP(美国病理学家协会)质量体系”认证的眼科专业医学检验实验室,通过转化应用前沿生命科学技术,充分赋能眼科疾病的治疗和防控。
《蓝皮书》对基因药物领域部分公司进行介绍,包括公司简介、发展历程、技术平台、在研管线、核心优势等。更多详细内容可参见完整版报告。




